Tabla periódica de elementos Hechos de torio
 Share
Share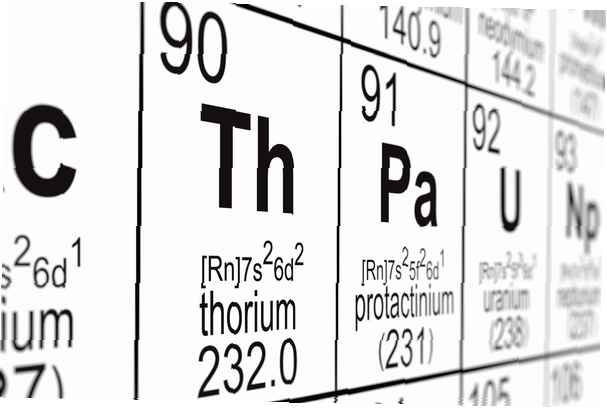
Número atómico: 90
Símbolo: Th
Peso atomico: 232.0381
Descubrimiento: Jons Jacob Berzelius 1828 (Suecia)
Configuración electronica: [Rn] 6d2 7s2
Origen de la palabra: Llamado así por Thor, el dios nórdico de la guerra y el trueno
Isótopos: Todos los isótopos del torio son inestables. Las masas atómicas oscilan entre 223 y 234. Th-232 ocurre naturalmente, con una vida media de 1.41 x 1010 años. Es un emisor alfa que pasa por seis pasos de desintegración alfa y cuatro beta para convertirse en el isótopo estable Pb-208.
Propiedades: El torio tiene un punto de fusión de 1750 ° C, punto de ebullición ~ 4790 ° C, gravedad específica de 11.72, con una valencia de +4 y, a veces, +2 o +3. El torio metálico puro es un blanco plateado estable al aire que puede retener su brillo durante meses. El torio puro es blando, muy dúctil y capaz de ser estirado, estampado y laminado en frío. El torio es dimórfico, pasando de una estructura cúbica a una estructura cúbica centrada en el cuerpo a 1400 ° C. El punto de fusión del óxido de torio es 3300 ° C, que es el punto de fusión más alto de los óxidos. El torio es atacado lentamente por el agua. No se disuelve fácilmente en la mayoría de los ácidos, excepto el ácido clorhídrico. El torio contaminado por su óxido se desvanecerá lentamente a gris y finalmente a negro. Las propiedades físicas del metal dependen en gran medida de la cantidad de óxido presente. El torio en polvo es pirofórico y debe manipularse con cuidado. El calentamiento de los giros de torio en el aire hará que se enciendan y ardan con una luz blanca brillante. El torio se desintegra para producir gas radón, un emisor alfa y peligro de radiación, por lo que las áreas donde se almacena o maneja el torio requieren buena ventilación..
Usos: El torio se utiliza como fuente de energía nuclear. El calor interno de la tierra se atribuye en gran medida a la presencia de torio y uranio. El torio también se usa para luces portátiles de gas. El torio se alea con magnesio para impartir resistencia a la fluencia y alta resistencia a temperaturas elevadas. La baja función de trabajo y la alta emisión de electrones hacen que el torio sea útil para recubrir el alambre de tungsteno utilizado en equipos electrónicos. El óxido se utiliza para fabricar crisoles de laboratorio y vidrio con baja dispersión y alto índice de refracción. El óxido también se usa como catalizador en la conversión de amoníaco en ácido nítrico, en la producción de ácido sulfúrico y en el craqueo de petróleo..
Fuentes: El torio se encuentra en la torita (ThSiO4 4) y torianita (ThO2 + UO2) El torio se puede recuperar de la monzonita, que contiene 3-9% de ThO2 asociado con otras tierras raras. El torio metálico se puede obtener reduciendo el óxido de torio con calcio, mediante la reducción del tetracloruro de torio con un metal alcalino, mediante la electrólisis del cloruro de torio anhidro en una mezcla fundida de cloruros de potasio y sodio, o mediante la reducción del tetracloruro de torio con cloruro de zinc anhidro.
Clasificación del elemento: Tierra rara radioactiva (actínido)
Datos físicos de torio
Densidad (g / cc): 11,78
Punto de fusión (K): 2028
Punto de ebullición (K): 5060
Apariencia: metal gris, blando, maleable, dúctil, radioactivo
Radio atómico (pm): 180
