¿Qué son los ácidos y las bases?
 Share
Share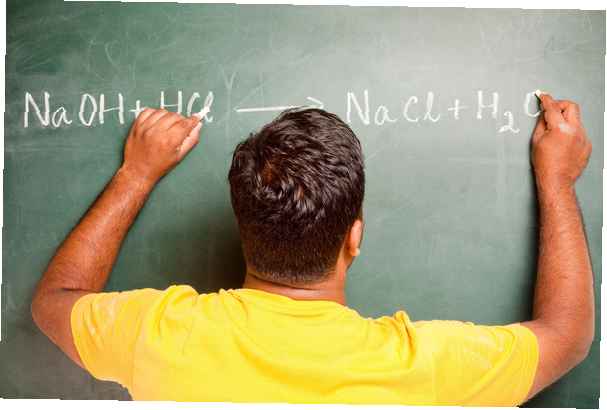
Existen varios métodos para definir ácidos y bases. Si bien estas definiciones no se contradicen entre sí, varían en cuán inclusivas son. Las definiciones más comunes de ácidos y bases son los ácidos y bases de Arrhenius, los ácidos y bases de Brønsted-Lowry y los ácidos y bases de Lewis. Antoine Lavoisier, Humphry Davy y Justus Liebig también hicieron observaciones sobre ácidos y bases, pero no formalizaron las definiciones..
Ácidos y bases de Svante Arrhenius
La teoría Arrhenius de ácidos y bases se remonta a 1884, basándose en su observación de que las sales, como el cloruro de sodio, se disocian en lo que él llamó iones cuando se coloca en el agua.
- los ácidos producen H+ iones en soluciones acuosas
- bases producen OH- iones en soluciones acuosas
- se requiere agua, por lo que solo permite soluciones acuosas
- solo se permiten los ácidos próticos; requerido para producir iones de hidrógeno
- solo se permiten bases de hidróxido
Johannes Nicolaus Brønsted - Ácidos y bases de Thomas Martin Lowry
La teoría de Brønsted o Brønsted-Lowry describe las reacciones ácido-base como un ácido que libera un protón y una base que acepta un protón. Si bien la definición de ácido es bastante similar a la propuesta por Arrhenius (un ion de hidrógeno es un protón), la definición de lo que constituye una base es mucho más amplia.
- los ácidos son donantes de protones
- las bases son aceptadores de protones
- se permiten soluciones acuosas
- se permiten bases además de hidróxidos
- solo se permiten los ácidos próticos
Gilbert Newton Lewis Ácidos y bases
La teoría de Lewis de ácidos y bases es el modelo menos restrictivo. No trata con protones en absoluto, sino que trata exclusivamente con pares de electrones.
- los ácidos son aceptores de pares de electrones
- las bases son donantes de pares de electrones
- menos restrictivo de las definiciones ácido-base
Propiedades de ácidos y bases.
Robert Boyle describió las cualidades de los ácidos y las bases en 1661. Estas características se pueden usar para distinguir fácilmente entre los dos químicos de configuración sin realizar pruebas complicadas:
Ácidos
- sabor agrio (¡no los pruebe!): la palabra 'ácido' proviene del latín acere, que significa 'agrio'
- los ácidos son corrosivos
- los ácidos cambian el tornasol (un tinte vegetal azul) de azul a rojo
- sus soluciones acuosas (agua) conducen corriente eléctrica (son electrolitos)
- reaccionar con bases para formar sales y agua
- evolucionar gas hidrógeno (H2) al reaccionar con un metal activo (como metales alcalinos, metales alcalinotérreos, zinc, aluminio)
Ácidos comunes
- ácido cítrico (de ciertas frutas y verduras, especialmente frutas cítricas)
- ácido ascórbico (vitamina C, como de ciertas frutas)
- vinagre (5% de ácido acético)
- ácido carbónico (para carbonatar refrescos)
- ácido láctico (en suero de leche)
Bases
- sabor amargo (¡no los pruebes!)
- se siente resbaladizo o jabonoso (¡no los toque arbitrariamente!)
- las bases no cambian el color del tornasol; pueden volver el tornasol rojo (acidificado) a azul
- sus soluciones acuosas (agua) conducen una corriente eléctrica (son electrolitos)
- reaccionar con ácidos para formar sales y agua
Bases Comunes
- detergentes
- jabón
- lejía (NaOH)
- amoníaco doméstico (acuoso)
Ácidos y bases fuertes y débiles
La fuerza de los ácidos y las bases depende de su capacidad para disociarse o romperse en sus iones en el agua. Un ácido fuerte o una base fuerte se disocia completamente (por ejemplo, HCl o NaOH), mientras que un ácido débil o una base débil solo se disocia parcialmente (por ejemplo, ácido acético).
La constante de disociación ácida y la constante de disociación base indican la fuerza relativa de un ácido o base. La constante de disociación ácida Kun es la constante de equilibrio de una disociación ácido-base:
HA + H2O ⇆ A- + H3O+
donde HA es el ácido y A- es la base conjugada.
Kun = [A-] [H3O+] / [HA] [H2O]
Esto se usa para calcular pKun, la constante logarítmica:
pkun = - registro10 Kun
Cuanto más grande es el pKun valor, cuanto menor es la disociación del ácido y más débil es el ácido. Los ácidos fuertes tienen un pKun de menos de -2.
