Tipos de reacciones químicas
 Share
Share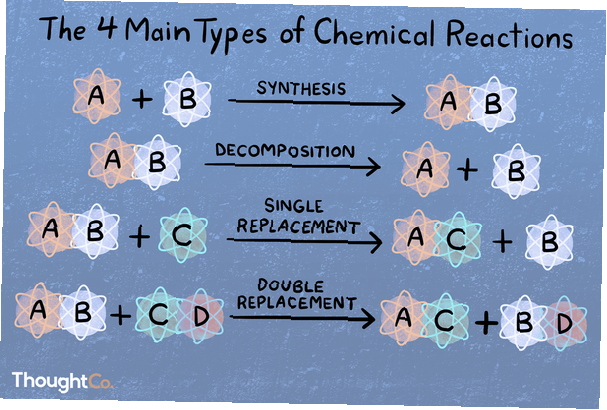
Una reacción química es un proceso generalmente caracterizado por un cambio químico en el que los materiales de partida (reactivos) son diferentes de los productos. Las reacciones químicas tienden a involucrar el movimiento de electrones, lo que lleva a la formación y ruptura de enlaces químicos. Existen varios tipos diferentes de reacciones químicas y más de una forma de clasificarlas. Aquí hay algunos tipos de reacción comunes:
Oxidación-Reducción o Reacción Redox
En una reacción redox, los números de oxidación de los átomos cambian. Las reacciones redox pueden implicar la transferencia de electrones entre especies químicas.
La reacción que ocurre cuando en la que yo2 se reduce a I- y S2O32- (anión tiosulfato) se oxida a S4 4O6 62- proporciona un ejemplo de una reacción redox:
2 S2O32−(aq) + I2(aq) → S4 4O6 62−(aq) + 2 I-(aq)
Combinación directa o reacción de síntesis
En una reacción de síntesis, dos o más especies químicas se combinan para formar un producto más complejo..
A + B → AB
La combinación de hierro y azufre para formar sulfuro de hierro (II) es un ejemplo de reacción de síntesis:
8 Fe + S8 → 8 FeS
Descomposición química o reacción de análisis
En una reacción de descomposición, un compuesto se descompone en especies químicas más pequeñas..
AB → A + B
La electrólisis del agua en oxígeno y gas hidrógeno es un ejemplo de una reacción de descomposición:
2 H2O → 2 H2 + O2
Desplazamiento único o reacción de sustitución
Una reacción de sustitución o desplazamiento único se caracteriza por un elemento que se desplaza de un compuesto por otro elemento.
A + BC → AC + B
Un ejemplo de reacción de sustitución ocurre cuando el zinc se combina con ácido clorhídrico. El zinc reemplaza al hidrógeno:
Zn + 2 HCl → ZnCl2 + H2
Metátesis o reacción de doble desplazamiento
En una reacción de doble desplazamiento o metátesis, dos compuestos intercambian enlaces o iones para formar diferentes compuestos..
AB + CD → AD + CB
Un ejemplo de una reacción de doble desplazamiento ocurre entre el cloruro de sodio y el nitrato de plata para formar nitrato de sodio y cloruro de plata..
NaCl (aq) + AgNO3(aq) → NaNO3(aq) + AgCl (s)
Reacción ácido-base
Una reacción ácido-base es un tipo de reacción de doble desplazamiento que ocurre entre un ácido y una base. El h+ ion en el ácido reacciona con el OH- ion en la base para formar agua y una sal iónica:
HA + BOH → H2O + BA
La reacción entre el ácido bromhídrico (HBr) y el hidróxido de sodio es un ejemplo de una reacción ácido-base:
HBr + NaOH → NaBr + H2O
Combustión
Una reacción de combustión es un tipo de reacción redox en la que un material combustible se combina con un oxidante para formar productos oxidados y generar calor (reacción exotérmica). Por lo general, en una reacción de combustión, el oxígeno se combina con otro compuesto para formar dióxido de carbono y agua. Un ejemplo de reacción de combustión es la quema de naftaleno:
C10H8 + 12 O2 → 10 CO2 + 4 H2O
Isomerización
En una reacción de isomerización, la disposición estructural de un compuesto cambia pero su composición atómica neta sigue siendo la misma..
Reacción de hidrólisis
Una reacción de hidrólisis implica agua. La forma general de una reacción de hidrólisis es:
X-(aq) + H2O (l) ↔ HX (aq) + OH-(aq)
Los principales tipos de reacción
¡Hay cientos o incluso miles de tipos de reacciones químicas! Si se le pide que nombre los principales 4, 5 o 6 tipos de reacciones químicas, así es como se clasifican. Los cuatro tipos principales de reacciones son combinación directa, reacción de análisis, desplazamiento simple y desplazamiento doble. Si le preguntan los cinco tipos principales de reacciones, son estas cuatro y luego ácido-base o redox (dependiendo de a quién le pregunte). Tenga en cuenta que una reacción química específica puede caer en más de una categoría..
